Trong hóa học cấu tạo của phân tử ammoniac $\left(NH_3\right)$ có dạng hình chóp tam giác đều mà đỉnh là nguyên tử nitrogen $(N)$ và đáy là tam giác $H_1H_2H_3$ với $H_1, H_2, H_3$ là vị trí của ba nguyên tử hydrogen $(H)$. Góc tạo bởi liên kết $H-N-H$, có hai cạnh là hai đoạn thẳng nối $N$ với hai trong ba điểm $H_1$, $H_2$, $H_3$ (chẳng hạn như $\widehat{H_1N H_2}$), được gọi là góc liên kết của phân tử $NH_3$. Góc này xấp xỉ $107^\circ$.
Trong không gian $Oxyz$, cho một phân tử $NH_3$ được biểu diễn bởi hình chóp tam giác đều $N.H_1H_2H_3$ với $O$ là tâm của đáy.
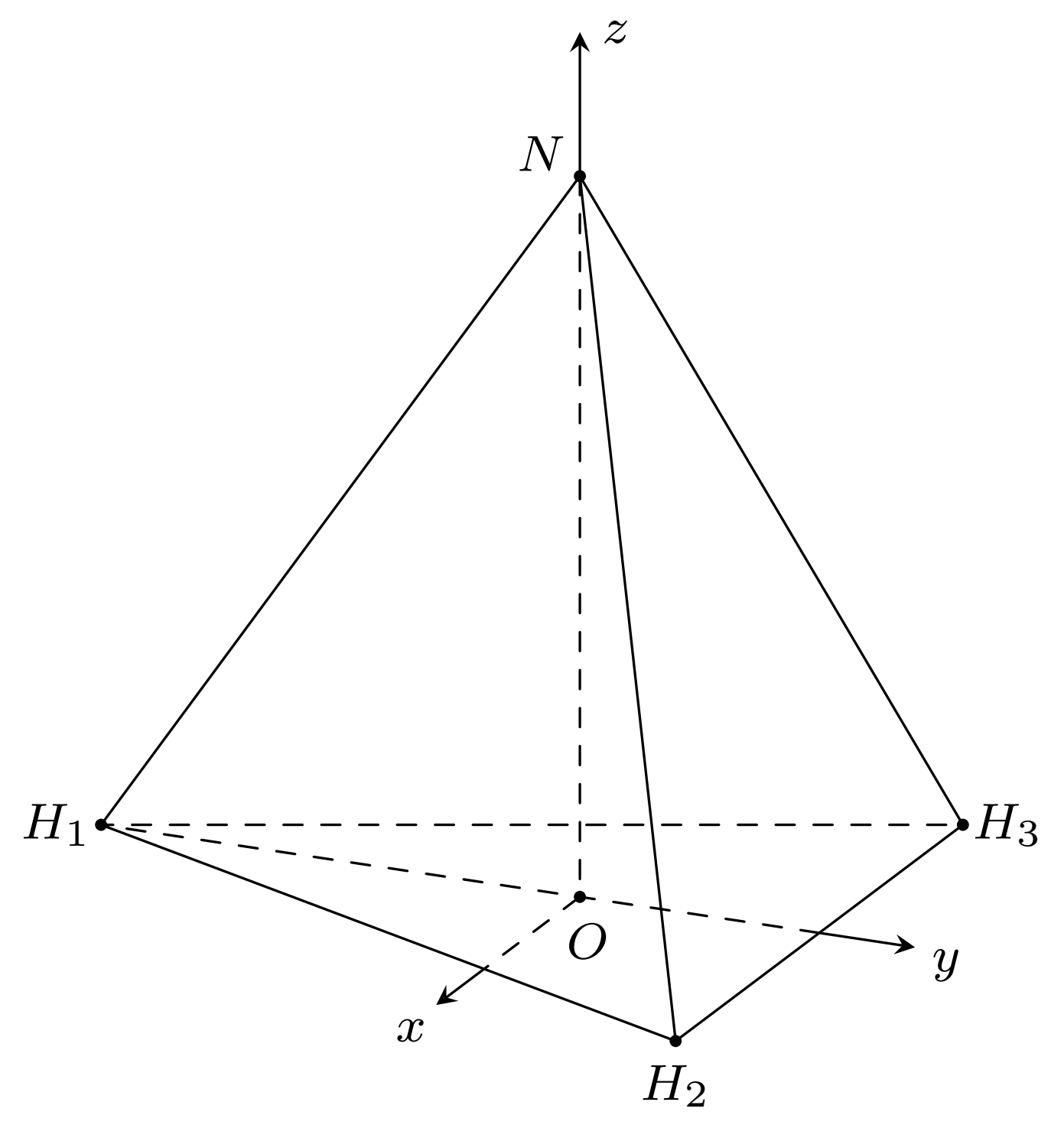
Nguyên tử nitrogen được biểu diễn bởi điểm $N$ thuộc trục $Oz$, ba nguyên tử hydrogen ở các vị trị $H_1$, $H_2$, $H_3$ trong đó $H_1\left(0;-\sqrt{3};0\right)$ và $H_1H_2$ song song với trục $Ox$. Tính khoảng cách giữa nguyên tử nitrogen với mỗi nguyên tử hydrogen (làm tròn kết quả đến hàng phần trăm).
Đáp án: 1,87
Lời giải:
Gọi $a=H_1H_2$ là khoảng cách giữa hai nguyên tử hydrogen, do tam giác $H_1H_2H_3$ đều tâm $O$, cạnh bằng $a$ nên ta có
$OH_1=\dfrac{\sqrt{3}}{3}H_1H_2 \Leftrightarrow\sqrt{3}=\dfrac{\sqrt{3}a}{3} \Leftrightarrow a=3.$
Vì $\widehat{H_2NH_3}$ là góc tạo bởi liên kết $H-N-H$ nên $\widehat{H_2NH_3}=107^\circ$.
Gọi $x$ là khoảng cách giữa nguyên tử nitrogen với mỗi nguyên tử hydrogen, khi đó $NH_2=NH_3=x$.
Áp dụng định lý côsin trong tam giác $NH_2H_3$ ta có
$\begin{array}{l} {H_2H_3}^2={NH_2}^2+{NH_3}^2-2\cdot NH_2\cdot NH_3\cdot\cos\widehat{H_2NH_3}\\ \Leftrightarrow 9=x^2+x^2-2x^2\cos107^\circ\\ \Leftrightarrow x \approx 1{,}87. \end{array}$
Vậy trong hệ trục tọa độ $Oxyz$ trên, khoảng cách giữa nguyên tử nitrogen với mỗi nguyên tử hydrogen là $1{,}87$.
